リチウムイオン電池初使用。 当社の設計におけるリチウムイオンおよびリチウムポリマー電池。
リチウムイオン電池は、対応するニッケル水素電池ほど「繊細」ではありませんが、それでも注意が必要です。 にこだわる 5つの簡単なルール、延長だけでなく可能 ライフサイクルリチウムイオン 電池だけでなく、稼働時間を増やすためにも モバイルデバイス充電せずに。
完全放電は避けてください。リチウムイオン電池にはいわゆるメモリー効果がないため、放電がゼロになるのを待たずに充電することができ、さらに充電する必要があります。 多くのメーカーは、リチウム イオン バッテリーの寿命を完全放電サイクル数 (最大 0%) で計算しています。 高品質のバッテリー用 400~600サイクル. リチウム イオン バッテリーの寿命を延ばすには、スマートフォンをより頻繁に充電してください。 最適には、バッテリー インジケーターが 10 ~ 20% のマークを下回ったらすぐに、電話を充電できます。 これにより、放電サイクル数が増加します。 1000-1100
.
専門家は、このプロセスを放電深度などの指標で説明しています。 お使いの携帯電話が 20% まで放電されている場合、放電深度は 80% です。 下の表は、リチウムイオン電池の放電サイクル数の放電深度への依存性を示しています。
3ヶ月に1回退院。長期間のフル充電は、リチウム イオン バッテリーに悪影響を及ぼします。
充電プロセスが非常に不安定であるため (私たちは、必要に応じて、USB、壁のコンセント、外部バッテリーなどから電話を充電することがよくあります)、専門家は 3 か月に 1 回、その後はバッテリーを完全に放電することを推奨しています。最大 100% まで充電でき、8 ~ 12 時間充電できます。 これは、いわゆる高および低バッテリ フラグをリセットするのに役立ちます。 これについて詳しく読むことができます。
一部充電済みのストア. リチウム イオン バッテリーの長期保管に最適な状態は、15°C で 30 ~ 50% の充電状態です。 バッテリーを完全に充電したままにしておくと、時間の経過とともに容量が大幅に減少します。 そしてバッテリーはこちら 長い時間ゼロに排出された棚にほこりが集まっていました。おそらく、テナントではなくなりました-リサイクルに送る時が来ました。
下の表は、リチウムイオン電池を1年間保管した場合の保管温度と充電レベルに応じた容量を示しています。 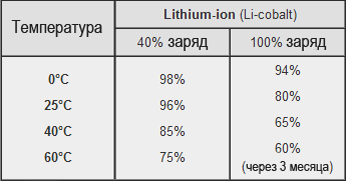
オリジナルの充電器を使用してください。ほとんどの場合、充電器はモバイル機器に直接組み込まれており、外部ACアダプターは家庭用電源の電圧を下げて電流を整流するだけであること、つまりバッテリーに直接影響を与えないことを知っている人はほとんどいません。 デジタルカメラなどの一部のガジェットには充電器が内蔵されていないため、リチウムイオン電池は外部の「充電器」に挿入されます。 これは、元の充電器の代わりに疑わしい品質の外部充電器を使用すると、バッテリーの性能に悪影響を及ぼす可能性がある場所です.
過熱を避けてください。さて、リチウムイオン電池の最大の敵は高温です。過熱にはまったく耐えられません。 そのため、モバイル機器を直射日光にさらしたり、電熱器などの熱源に近づけたりしないでください。 最大 許容温度、リチウムイオン電池を使用することが可能です: -40°C ~ +50°C
また、あなたが見ることができます
- 翻訳
電池切れ:私たちは皆、それが起こるのを見てきました。 電話、ラップトップ、カメラ、そして現在の電気自動車では、このプロセスは苦痛であり、運が良ければ遅い. かつては何時間も (場合によっては数日も) デバイスに電力を供給していたリチウム イオン バッテリーは、何年にもわたって、充電を保持する能力を徐々に失います。 結局、あなたは折り合いをつけ、おそらくスティーブ・ジョブズを呪い、新しいバッテリーや新しいガジェットを購入するでしょう.
しかし、なぜこれが起こっているのですか? 最後の息を吹き返すバッテリーの中で何が起こるのでしょうか? 簡単に言えば、高温への長時間の暴露と多数の充電および放電サイクルによる損傷により、電極間のリチウムイオンの移動が最終的に中断され始めるということです。
望ましくない化学反応、腐食、高温の脅威、およびパフォーマンスに影響を与えるその他の要因について説明するより詳細な答えは、すべてが正常に機能しているときにリチウムイオン電池で何が起こるかの説明から始まります.
リチウムイオン電池の紹介
 典型的なリチウム イオン電池では、リチウム コバルト酸化物などのリチウムの酸化物で作られたカソード (または負電極) があります。 また、今日では通常グラファイトでできているアノードまたは正極も見つかります。 薄い多孔性のセパレーターが 2 つの電極を離し、短絡を防ぎます。 また、有機溶媒とリチウム塩をベースにした電解質は、リチウムイオンがセル内を移動できるようにします。
典型的なリチウム イオン電池では、リチウム コバルト酸化物などのリチウムの酸化物で作られたカソード (または負電極) があります。 また、今日では通常グラファイトでできているアノードまたは正極も見つかります。 薄い多孔性のセパレーターが 2 つの電極を離し、短絡を防ぎます。 また、有機溶媒とリチウム塩をベースにした電解質は、リチウムイオンがセル内を移動できるようにします。 充電中 電気リチウムイオンをカソードからアノードに移動させます。 放電中(つまり、バッテリーを使用しているとき)、イオンはカソードに向かって移動します。
アルゴンヌ国立研究所の科学者で、リチウム イオン電池の劣化に関する科学的研究を行っている Daniel Abraham は、このプロセスを水力発電システムの水と比較しました。 水が上に移動するにはエネルギーが必要ですが、非常に簡単に下に流れます。 実際、それは運動エネルギーを供給している、と Abraham は言う。同様に、カソードのリチウム-コバルト酸化物は「そのリチウムをあきらめたくない」。 水が上に移動するように、リチウム原子を酸化物からアノードに移動させるにはエネルギーが必要です。
充電中、イオンはアノードを構成するグラファイトのシートの間に配置されます。 しかし、アブラハムが言ったように、「彼らはそこにいたくありません。最初の機会に、水が丘を下って流れるので、彼らは戻ってきます」. これが放電です。 長寿命のバッテリーは、数千回の充放電サイクルに耐えることができます。
切れたバッテリーが本当に切れるのはいつですか?
 「切れた」バッテリーについて話すときは、エネルギーと電力という 2 つのパフォーマンス メトリクスを理解することが重要です。 場合によっては、バッテリーからエネルギーを引き出す速度が非常に重要になります。 これが力です。 電気自動車では、高出力により急速な加速と減速が可能になり、バッテリーを数秒以内に充電する必要があります。
「切れた」バッテリーについて話すときは、エネルギーと電力という 2 つのパフォーマンス メトリクスを理解することが重要です。 場合によっては、バッテリーからエネルギーを引き出す速度が非常に重要になります。 これが力です。 電気自動車では、高出力により急速な加速と減速が可能になり、バッテリーを数秒以内に充電する必要があります。 で 携帯電話一方、高出力は、容量、つまりバッテリーが保持できる電力量よりも重要ではありません。 1回の充電で長持ちする大容量バッテリー。
時間の経過とともに、バッテリーは容量と電力の両方に影響を与えるさまざまな方法で劣化し、最終的には基本的な機能を実行できなくなります。
別の水のアナロジーで考えてみてください。バッテリーの充電は、バケツに水道水を入れるようなものです。 バケツの容積は、バッテリーの容量、または容量を表します。 蛇口をフルパワーまたは細流で回すことによって、それを満たすことができる速度がパワーです. しかし、時間、高温、複数のサイクル、およびその他の要因により、最終的にバケツに穴が開いてしまいます。
バケツの例えでは、水が浸透します。 バッテリーでは、リチウムイオンが取り除かれている、つまり「付着している」とエイブラハムは言う。 その結果、電極間を移動できなくなります。 そのため、数か月後には、最初は数日に 1 回充電する必要があった携帯電話が、毎日充電する必要が生じるようになりました。 それから1日2回。 最終的に、あまりにも多くのリチウム イオンが「結合」し、バッテリーは有効な電荷を保持できなくなります。 バケツは水を保持しなくなります。
壊れるものとその理由
 カソードの活性部分 (バッテリー内のリチウム イオン源) は、安定性と性能を確保するために特定の原子構造で設計されています。 イオンが陽極に移動して陰極に戻るとき、安定した結晶構造を維持するために元の場所に戻ることが理想的です。
カソードの活性部分 (バッテリー内のリチウム イオン源) は、安定性と性能を確保するために特定の原子構造で設計されています。 イオンが陽極に移動して陰極に戻るとき、安定した結晶構造を維持するために元の場所に戻ることが理想的です。 問題は、充電と放電のたびに結晶構造が変化する可能性があることです。 アパートAからのイオンは必ずしも家に帰るとは限りませんが、隣のアパートBに移動することができます. 次に、アパートBのイオンは、この浮浪者が自分の場所を占めていることに気づき、対立することなく、廊下に落ち着くことを決定します。 等。
徐々に、物質のこれらの「相転移」は、異なる電気化学特性を持つ結晶の新しい結晶構造にカソードを変換します。 必要なパフォーマンスを最初に提供する原子の正確な配置はさまざまです。
ハイブリッド車のバッテリーは、車両が加速またはブレーキをかけたときにのみ電力を供給する必要があると、Abraham 氏は指摘します。これらの構造変化は、電気自動車よりもはるかにゆっくりと発生します。 これは、各サイクルでシステム内を移動するリチウム イオンのごく一部しかないためです。 その結果、元の位置に戻りやすくなります。
腐食の問題
 劣化は、バッテリーの他の部分でも発生する可能性があります。 各電極は集電体に接続されています。集電体は基本的に、電子を収集して外部回路に移動させる金属片 (通常、陽極は銅、陰極はアルミニウム) です。 そのため、リチウムコバルト酸化物(セラミックであり、あまり良い導体ではありません)などの「活性」材料で作られた粘土と、金属片に塗布された接着剤のような接着剤があります。
劣化は、バッテリーの他の部分でも発生する可能性があります。 各電極は集電体に接続されています。集電体は基本的に、電子を収集して外部回路に移動させる金属片 (通常、陽極は銅、陰極はアルミニウム) です。 そのため、リチウムコバルト酸化物(セラミックであり、あまり良い導体ではありません)などの「活性」材料で作られた粘土と、金属片に塗布された接着剤のような接着剤があります。 接合材が破壊されると、集電体表面の「剥がれ」につながります。 金属が腐食すると、電子を効率的に移動できなくなります。
バッテリーの腐食は、電解質と電極の間の相互作用に起因する可能性があります。 グラファイトアノードは「光放出」です。 電解質に電子を簡単に「与える」。 これは、グラファイトの表面に望ましくないコーティングをもたらす可能性があります。 一方、カソードは非常に「酸化しやすい」ため、電解質から電子を容易に受け取るため、場合によっては集電体のアルミニウムを腐食させたり、カソードの一部にコーティングを形成したりする可能性があると Abraham 氏は言います。
良すぎる
 アノードの材料として広く使用されている黒鉛は、有機電解質中で熱力学的に不安定です。 これは、バッテリーの最初の充電からグラファイトが電解質と反応することを意味します。 これにより、最終的にアノードをさらなる攻撃から保護する多孔質層 (固体電解質界面または SEI と呼ばれる) が作成されます。 この反応も消費します たくさんのリチウム。 理想的な世界では、この反応が 1 回発生して保護層が作成され、それで終了します。
アノードの材料として広く使用されている黒鉛は、有機電解質中で熱力学的に不安定です。 これは、バッテリーの最初の充電からグラファイトが電解質と反応することを意味します。 これにより、最終的にアノードをさらなる攻撃から保護する多孔質層 (固体電解質界面または SEI と呼ばれる) が作成されます。 この反応も消費します たくさんのリチウム。 理想的な世界では、この反応が 1 回発生して保護層が作成され、それで終了します。 ただし、実際には、TEI は非常に不安定なディフェンダーです。 Abraham によると、室温ではグラファイトを十分に保護しますが、高温またはバッテリーがゼロ (「深放電」) になると、EMT は電解質に部分的に溶解する可能性があります。 高温では、電解質も分解する傾向があり、副反応が加速されます。
好条件が戻ると、別の保護層が形成されますが、これによりリチウムの一部が消費され、漏れやすいバケツと同じ問題が発生します。 携帯電話をより頻繁に充電する必要があります。
したがって、グラファイト アノードを保護するには TEI が必要です。 保護層が厚くなりすぎると、自由に行き来するために必要なリチウムイオンに対する障壁になります。 これは電力に影響を与え、エイブラハム氏は電気自動車にとって「非常に重要」であると指摘しています。
より良いバッテリーの構築
 では、バッテリーの寿命を延ばすにはどうすればよいでしょうか? 研究室の研究者は、私たちの食事に含まれるビタミンのように機能する電解質サプリメントを探しています。 電極と電解質の間の有害な反応を減らすことで、電池の性能を向上させ、長持ちさせることができると Abraham は言います。 さらに、電極用の新しい、より安定した結晶構造、およびより安定したバインダーと電解質を探しています。
では、バッテリーの寿命を延ばすにはどうすればよいでしょうか? 研究室の研究者は、私たちの食事に含まれるビタミンのように機能する電解質サプリメントを探しています。 電極と電解質の間の有害な反応を減らすことで、電池の性能を向上させ、長持ちさせることができると Abraham は言います。 さらに、電極用の新しい、より安定した結晶構造、およびより安定したバインダーと電解質を探しています。 一方、バッテリーおよび電気自動車メーカーのエンジニアは、リチウムイオンバッテリーを一定の健康的な温度範囲に保つために、エンクロージャーと熱管理システムに取り組んでいます。 私たちは消費者として、極端な温度と過放電を避けることを余儀なくされており、常にバッテリーがすぐに切れてしまうと不平を言い続けています。
現在、プレーヤーや携帯電話からラップトップ タブレットに至るまで、ほとんどのモバイル デバイスでリチウム イオンおよびリチウム ポリマー バッテリーが使用されています。
リチウムイオン(および電解質の種類のみが異なるリチウムポリマー電池)は、かなり前の1992年に市場に登場しました。 技術は細部に至るまで練り上げられ、繰り返し改善されました。容量、安定性、耐久性に影響を与えるすべての要因は既知であり、バッテリーやガジェットの開発者によって考慮され、携帯機器のマニュアルや多くの出版物に反映されています。インターネットと紙のプレス。 しかし、モバイル機器の販売者やおなじみの「教祖」から聞くことができるバッテリーの取り扱いに関するヒントの中で、単に役に立たないものとまったく有害なものの両方を聞くことができます。 最後に、バッテリー寿命を延ばすための適切な推奨事項のリストを作成しましょう.
1. 元の充電器でバッテリーを充電します。 オリジナルのバッテリーを使用してください。
ブランドのバッテリーとメモリの安価なアナログの特性は、オリジナルのものとはパラメータが著しく異なる場合があります。 それからだと思われますが、公称を超えていることをご存知でしたか 充電電圧わずか0.15Vのバッテリーでバッテリーの寿命が半分になる?
また、充電電圧が0.1V低下すると、充電されたバッテリーの容量は約10%減少します。 それどころか、彼女にとってこれは有害ではありませんが、バッテリー寿命の短縮に満足することはありませんよね?
問題は、携帯電話やスマートフォンでは、バッテリー充電コントローラーが電話自体のボード上にあることです。 それらは「ネイティブ」バッテリーのみを充電するように「訓練」されており、互換性のあるアナログがオリジナルと異なる場合 (ほとんどの場合そうです)、上記の状況のいずれかが発生する可能性があります。 したがって、お金を節約し、この場合、「ネイティブ」バッテリーを使用して充電するというアドバイスには、非常に実用的な正当性があります。
2. 初めて使用する前に、バッテリーを完全に充電してください。
これは、まず第一に、受電デバイスがその全容量を正しく判断し、その後、残りの充電を正確に表示するために必要です。 ただし、一部のベンダーが推奨するように、デバイスを「一晩中」または「12 時間」充電したままにしないでください。 これは無駄だから 電話に組み込まれ、バッテリーに組み込まれた充電コントローラー 電子回路保護機能は、容量がいっぱいになると充電をオフにするだけです。
3 ~ 5 回のフル サイクルの「トレーニング」または「ビルドアップ」では、リチウム イオン バッテリーも必要ありません。 最初の充電後、リチウムイオンバッテリーは完全に使用できる状態になります。 深い放電は彼女にとってストレスになり、彼女の人生を短くするだけです. いわゆるバッテリーの「キャリブレーション」を実行し、その充電を正しく表示するために、一部のデバイスでのみ完全なサイクルが必要になる場合があります。 ただし、バッテリー自体は必要ありません。
3. 温度体制を観察します。
リチウムイオン電池は、自分が快適に感じられない環境で保管したり、使用したりしないでください。 リチウムイオン電池は、-20°C 以下の温度では実質的に正常に動作しません。 また、+30 °C 以上では、老化プロセスが加速され、容量の一部が不可逆的に失われ、早期の故障につながります。 したがって、スマートフォンを凍結や過熱にさらさないでください。
バッテリーの充電および放電に最適な温度は、約 +20 °C です。 同時に、-18°Cまでの負の温度での放電は、バッテリーに害を及ぼすことはありません(通常よりもはるかに速く発生しない限り)。 しかし、寒さの中で断固として充電することはできません。これは有害で危険です。 そのため、より快適な環境でバッテリーを充電してください。
4. バッテリーを完全に消耗させたり、100% 充電を追い求めたりしないでください。
古いニッケル水素電池とは異なり、リチウムイオン電池は満充電も過放電も一種のストレスです。 フル サイクルを頻繁に行うと、バッテリーの寿命が著しく短くなる可能性があります。
可能であれば、充電レベルが低い (10 ~ 15%) という警告が表示されたら、ガジェットが自動的にオフになるのを待たずに、すぐにガジェットを充電してください。 保護シャットダウンが発生した場合は、バッテリーを長時間放電したままにしないでください。少なくとも容量の30〜40%まで急速に充電する必要があります。
100% まで、バッテリーを完全に充電しないこともいいでしょう。 ただし、実際には、この推奨事項を実装するのは困難ですが、一部のラップトップ メーカー (Samsung) は既にこのモードをデバイスに提供しています。
5. 未使用電池の保管ルール
棚や店頭のカウンターに横たわっていても、バッテリーは容量のかなりの部分を失います。このプロセスの速度は、充電の程度と保管温度に直接依存します。
保管温度 1 年間保管した後のバッテリーの残量 (リソース):
初期充電レベル 40% および初期充電レベル 100% で
0℃ 98% 94%
25℃ 96% 80%
40℃ 85% 65%
60℃ 75% 60% (3ヶ月後)
保存温度と充電状態による最も一般的なリチウムコバルト電池の特性の劣化
したがって、バッテリーを「予備」で購入しても意味がありません。 また、新しいバッテリーを購入するときは、その製造日を確認する必要があります。
めったに使用しないが、動作状態を維持したいデバイスのバッテリーをお勧めします。
• 最大 40 ~ 50% 充電。
• 受電装置から取り外します。
• 密封されたビニール袋に入れます (バッテリーが複数ある場合は、各バッテリーを個別に)。
• 冷蔵庫に保管してください (ただし、決して冷蔵庫に入れないでください)。 冷凍庫!);
• 2 ~ 3 か月に 1 回、室温まで温めた後、同じ 40 ~ 50% まで充電します。
• 長期間保管した後は、使用前に完全に充電してください。
リチウムイオン電池とリチウムポリマー電池にはさまざまなサイズと形状がありますが、エチケットはすべての種類で同じです。
放電したバッテリーを長時間放置しないでください。 数週間で、自己放電により、切れたバッテリーの電圧が臨界電圧を下回り、2.2 ~ 2.9 V に低下します。この場合、保護回路がバッテリーを「スリープ」モードにしてオフにします。 その後、通常の充電器は、おそらくこの状態から抜け出すことができなくなります。
故障したバッテリーを自分で分解したり修理しようとしたりしないでください。 まず、コントローラと保護装置を組み合わせると、(回路が)非常に複雑な装置になり、特別な装置がないと理解できません。 第二に、安全ではないかもしれません。 同時に、リチウム イオン バッテリー セルを分解する (開く) ことは固く禁じられています。 バッテリーを機械的損傷から保護することも価値があります。
特に 60°C 以上で、リチウム イオン バッテリーを凍結または過熱しないでください。重大な過熱または損傷を伴う急速な故障に加えて、リチウム電池の爆発または自然発火の危険があります。 したがって、リチウムイオン電池ははんだ付けが厳禁であり、工場で抵抗スポット溶接によって電池に組み立てられます。
リチウムベースの電源にはほぼ 1 世紀の歴史がありますが、前世紀の 90 年代まで、技術の不完全性のために大量生産されることはありませんでした。 初期の開発で使用されたリチウム金属は反応性が高すぎるため、それをベースにしたバッテリーが頻繁に発火したり爆発したりしました。 ソニーのエンジニアは、リチウムを活性の低いコバルト酸リチウムに置き換えることで、技術的なブレークスルーを達成しました。 彼らはまた、バッテリーセルの電気的および物理的パラメーターを制御し、通常の操作に違反した場合に充電または放電を停止するBMS(バッテリー管理システム)制御および保護システムを導入しました。 それ以来、技術と材料は大幅に改善され、現在、リチウムイオン電池は非常に高度で信頼性が高く安全なデバイスです。 当然、上記の推奨事項に従います。
リチウムイオン電池の寿命を延ばす方法。

リチウムイオン電池は、最新の携帯電話、ラップトップ、タブレットに使用されています。 次第に、彼らはポータブル電子機器市場からアルカリ電池を追い出しました。 以前は、これらのデバイスはすべてニッケルカドミウム電池とニッケル水素電池を使用していました。 しかし、Li─Ion バッテリーのように、それらの時代は終わりました。 最高のパフォーマンス. 確かに、それらはあらゆる点でアルカリ性のものを置き換えることはできません。 たとえば、ニッケルカドミウム電池が生成できる電流は、それらには達成できません。 スマートフォンやタブレットの能力にとって、これは重要ではありません。 しかし、消費電流の多い携帯電動工具の分野では、いまだにアルカリ乾電池が使われています。 ただし、カドミウムを使用しない高放電電流のバッテリーの開発作業は継続されています。 今日は、リチウムイオン電池、その設計、運用、開発の見通しについてお話します。
リチウム アノードを備えた最初のバッテリー セルは、前世紀の 70 年代に製造されました。 それらは高い特定のエネルギー強度を持っていたため、すぐに需要がありました。 専門家は長い間、に基づいて情報源を開発しようとしてきました。 アルカリ金属、非常にアクティブです。 これにより、このタイプの電池の高電圧と比エネルギーが達成されました。 同時に、そのような要素の設計の開発は非常に迅速に行われましたが、それらの実際の使用は困難を引き起こしました。 彼らは前世紀の90年代にのみ対処することができました。

この 20 年の間に、研究者たちは主な問題はリチウム電極にあるという結論に達しました。 この金属は非常に活性が高く、動作中に多くのプロセスが発生し、最終的に発火に至りました。 これがフレームベンチレーションと呼ばれるようになりました。 このため、90 年代初頭に、メーカーはバッテリーのリコールを余儀なくされました。 携帯電話.
それは一連の事故の後に起こりました。 会話の時、バッテリーの消費電流が最大になり、炎の噴出とともに換気が始まった。 その結果、使用者による顔面火傷の事例が多発しています。 したがって、科学者はリチウムイオン電池の設計を改良する必要がありました。
リチウム金属は、特に充放電時に非常に不安定です。 したがって、研究者は充電式バッテリーを作成し始めました リチウム系リチウムを使用せずに。 このアルカリ金属のイオンが使用され始めました。 それが彼らの名前の由来です。
リチウム イオン電池は、より低い比エネルギーを持っています。 しかし、充電と放電の基準が守られていれば安全です。
リチウムイオン電池の反応
家庭用電化製品にリチウムイオン電池を導入する方向へのブレークスルーは、負極が炭素材料で作られた電池の開発でした。 炭素の結晶格子は、リチウム イオンのインターカレーションのマトリックスとして非常に適しています。 電池の電圧を上げるために、正極はコバルト酸化物でできていました。 印刷された酸化コバルトの電位は約 4 ボルトです。
ほとんどのリチウム イオン バッテリーの動作電圧は 3 ボルト以上です。 負極での放電中、リチウムは炭素からデインターカレートされ、正極の酸化コバルトにインターカレートされます。 充電プロセス中は、プロセスが逆に発生します。 システムには金属リチウムが存在しないことが判明しましたが、そのイオンは電極から別の電極に移動して電流を生成します。
負極での反応
リチウムイオン電池の最新の商用モデルはすべて、炭素含有材料で作られた負極を備えています。 炭素へのリチウムインターカレーションの複雑なプロセスは、この材料の性質と電解質物質に大きく依存します。 アノード上の炭素マトリックスは層状構造を持っています。 構造は、規則的 (天然または合成黒鉛) または部分的に規則的 (コークス、すすなど) にすることができます。
インターカレーション中、リチウム イオンは炭素層を押し離し、それらの間に浸透します。 様々なインターカレートが得られます。 インターカレーションとデインターカレーションの間、炭素マトリックスの比容積はわずかに変化します。 負極には、炭素材料に加えて、銀、スズおよびそれらの合金を使用することができる。 また、シリコン、硫化スズ、コバルト化合物などとの複合材料の使用も試みています。
正極での反応
一次リチウム電池 (バッテリー) は、多くの場合、最も多く使用されます。 異なる材料. 電池ではこれができず、材料の選択が制限されます。 したがって、リチウムイオン電池の正極は、リチウム化されたニッケルまたは酸化コバルトでできています。 リチウムマンガンスピネルも使用できます。
現在、カソード用の混合リン酸塩または酸化物からの材料に関する研究が進行中です。専門家が証明したように、そのような材料はリチウムイオン電池の電気的特性を改善します。 カソード表面に酸化物を堆積させる方法も開発されています。
充電中にリチウム イオン バッテリで発生する反応は、次の式で表すことができます。
正極
LiCoO 2 → Li 1-x CoO 2 + xLi + + xe -
負極
C + xLi + + xe - → CLi x
放電プロセス中、反応は反対方向に進行します。
下図は、リチウムイオン電池の充放電過程を模式的に表したものです。
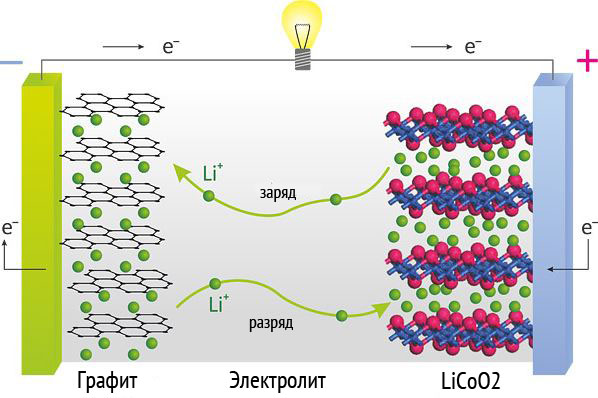
リチウムイオン電池装置
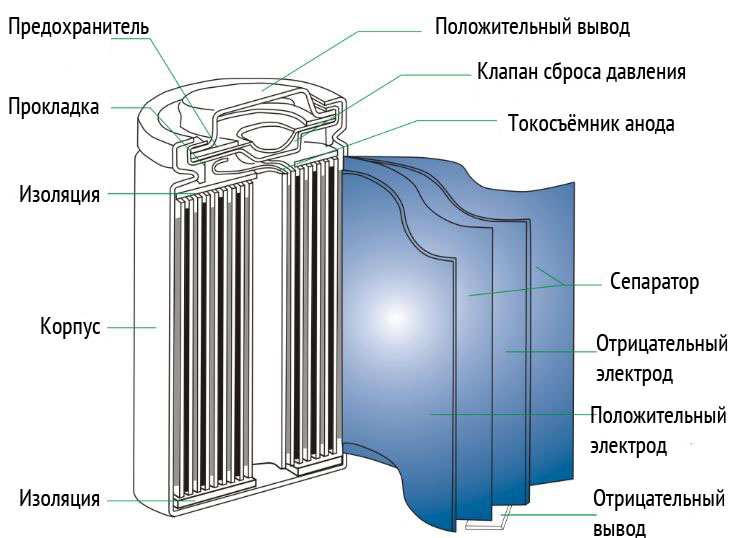
設計によると、リチウムイオン電池は円筒形と角形のデザインで作られています。円筒形のデザインは、電極を分離するためのセパレーター材料を備えた電極のロールです。 このロールは、アルミニウムまたはスチールのケーシングに収納されています。 マイナス電極はそれに接続されています。
プラスの接点は、バッテリーの端にあるパッドの形で表示されます。
角形のリチウムイオン電池は、長方形の板を積み重ねて作られています。 このようなバッテリーは、パッケージングをより密にすることを可能にします。 困難は、電極の圧縮力を維持することにあります。 渦巻き状にねじられた電極のロールアセンブリを持つ角型電池があります。
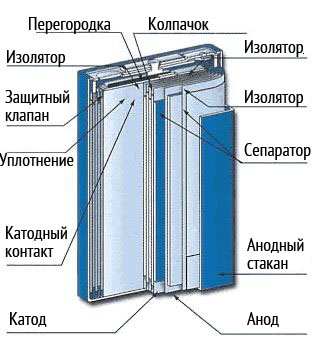
すべてのリチウムイオン電池は、安全に動作するように設計されています。 まず第一に、これは加熱と発火の防止に関するものです。 バッテリーカバーの下に、バッテリーの抵抗が大きくなるにつれて抵抗が増加するメカニズムが組み込まれています 温度係数. バッテリー内の圧力が許容限界を超えると、このメカニズムによりプラス端子とカソードが破損します。
さらに、リチウムイオン電池での動作の安全性を高めるために、電子基板が必須です。 その目的は、過熱や短絡を排除するために、充電と放電のプロセスを制御することです。
現在、多くの角型リチウムイオン電池が生産されています。 彼らはスマートフォンやタブレットでアプリケーションを見つけます。 角形電池の設計は、単一の統一がないため、メーカーごとに異なることがよくあります。 逆極性の電極はセパレーターで分離されています。 その製造には、多孔性ポリプロピレンが使用されます。
Li-Ion およびその他のタイプのリチウム電池の設計は、常に密閉されています。 この 必須要件、電解液の漏れは許容されないためです。 漏れると、電子機器が損傷します。 さらに、密閉設計により、水や酸素がバッテリーに侵入するのを防ぎます。 内部に入ると、電解液や電極と反応して電池を破壊します。 部品の製造 リチウム電池それらの組み立ては、アルゴン雰囲気の特別なドライボックス内で行われます。 この場合、溶接、シーリングなどの複雑な方法が使用されます。
リチウムイオン電池の活動量に関しては、メーカーは常にここで妥協点を探しています。 最大容量を達成し、操作の安全性を確保する必要があります。 関係は以下に基づいています。
A o / A n \u003d 1.1、ここで
A o は、負極の活性質量です。
そして p は正極の活性質量です。
このバランスにより、リチウム (純金属) の形成が防止され、発火が防止されます。
リチウムイオン電池のパラメータ
現在生産されているリチウムイオン電池は、エネルギー密度が高く、 動作電圧. ほとんどの場合、後者は 3.5 から 3.7 ボルトです。 エネルギー強度は、1 キログラムあたり 100 から 180 ワット時、または 1 リットルあたり 250 から 400 です。 少し前まで、メーカーは数アンペアアワーを超える容量のバッテリーを製造できませんでした。 現在、この方向の開発を妨げる問題は解消されています。 そのため、数百アンペア時の容量を持つリチウムタイプのバッテリーが販売され始めました。

最新の Li─Ion バッテリーの放電電流は、2C から 20C の範囲です。 それらは温度範囲で動作します 環境-20 から +60 摂氏。 -40 ℃で効率的なモデルがあります。 しかし、特別なシリーズのバッテリーは負の温度で動作することはすぐに言う価値があります. 通常の携帯電話用リチウムイオン電池は、低温下では動作しなくなります。
このタイプのバッテリーの自己放電は、最初の 1 か月で 4 ~ 6% です。 さらに、それは減少し、年に数パーセントになります。 これは、ニッケルカドミウム電池やニッケル水素電池に比べて大幅に少なくなります。 寿命は充放電サイクル400~500回程度です。
それでは、リチウムイオン電池の動作の特徴について話しましょう。
リチウムイオン電池の作動
リチウムイオン電池の充電
リチウムイオン電池の充電は通常組み合わせて行います。 まず、電圧が 4.1 ~ 4.2 ボルトになるまで、0.2 ~ 1C の定電流で充電します。 そして、充電はで行われます 定電圧. 最初のステップは約 1 時間続き、2 番目のステップは約 2 時間続きます。 バッテリーをより速く充電するには、パルスモードを使用します。 当初、グラファイトを使用したリチウムイオン電池が製造され、セルあたり 4.1 ボルトの電圧制限が設定されました。 実際には、セル内の電圧が高くなると、副反応が始まり、これらのバッテリーの寿命が短くなります。
徐々に、これらの欠点は、グラファイトにさまざまな添加剤を合金化することで解消されました。 最新のリチウムイオン電池は、最大 4.2 ボルトまで問題なく充電できます。エラーはセルあたり 0.05 ボルトです。 高い信頼性と長い耐用年数が求められる軍事および産業部門向けのリチウムイオン電池のグループがあります。 そのような電池のために耐えます 最大電圧要素あたり 3.90 ボルト。 エネルギー密度はわずかに低くなりますが、耐用年数は長くなります。
1Cの電流でリチウムイオン電池を充電すると、フルセットの容量の時間は2〜3時間になります。 電圧が最大に上昇し、電流が充電プロセスの開始時の値の 3% に低下すると、バッテリは完全に充電されたと見なされます。 これは下のチャートで見ることができます。
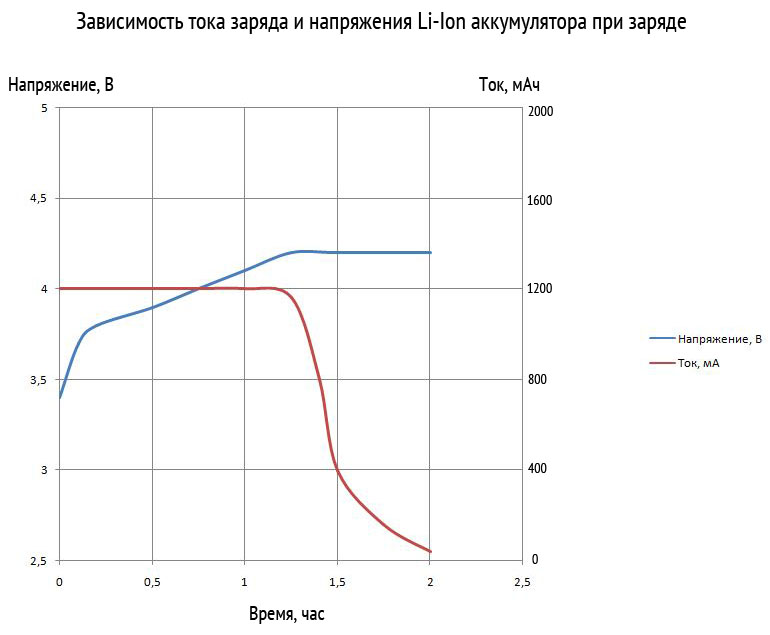
下のグラフは、Li─Ion バッテリーの充電段階を示しています。
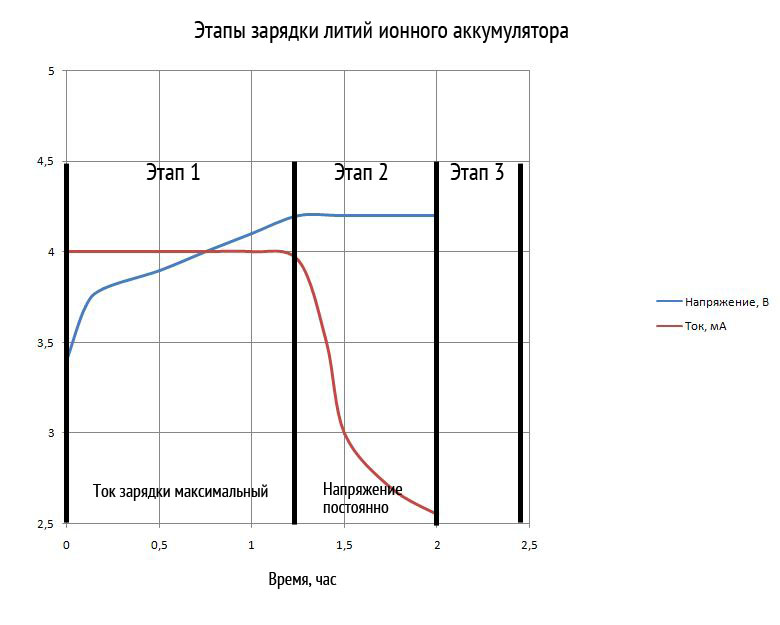
充電プロセスは、次の手順で構成されます。
- ステージ 1. このステージでは、水がバッテリーを流れます。 最大電流充電。 しきい値電圧に達するまで続きます。
- ステージ 2. バッテリ電圧が一定の場合、充電電流は徐々に減少します。 この段階は、電流が初期値の 3% に減少すると終了します。
- ステージ 3. バッテリーが保管されている場合、このステージでは、自己放電を補うために定期的な充電が行われます。 約 500 時間ごとに実行されます。
充電電流を増やしてもバッテリの充電時間は短縮されないことは、実際に知られています。 電流が増加すると、電圧はしきい値までより速く上昇します。 しかしその後、充電の第 2 段階はより長く続きます。 一部の充電器 (充電器) は、Li─Ion バッテリーを 1 時間で充電できます。 そのようなメモリには第 2 段階はありませんが、実際にはこの時点でバッテリーはどこかで 70% 充電されています。
ジェット充電に関しては、リチウムイオンバッテリーには適用できません。 これは、このタイプのバッテリーが再充電時に余分なエネルギーを吸収できないためです。 ジェット再充電により、一部のリチウム イオンが金属状態 (原子価 0) に遷移する可能性があります。
短い充電は、自己放電と電気エネルギーの損失を十分に補償します。 第3段階の充電は500時間ごとに行うことができます。 原則として、バッテリー電圧が1つの要素で4.05ボルトに低下したときに実行されます。 充電は、電圧が 4.2 ボルトに上昇するまで行われます。
リチウムイオン電池の過充電に対する耐性が弱いことは注目に値します。 炭素マトリックス(負極)に過剰な電荷を加えた結果、リチウム金属の析出が始まります。 化学活性が非常に高く、電解質と相互作用します。 その結果、カソードで酸素の発生が始まり、ケース内の圧力が上昇して減圧される恐れがあります。 したがって、コントローラーをバイパスして Li─Ion セルを充電する場合は、充電時に電圧がバッテリー メーカーの推奨よりも高くならないようにしてください。 定期的に充電すると、バッテリーの寿命が短くなります。
メーカーは、リチウムイオン電池の安全性に細心の注意を払っています。 電圧が許容レベルを超えると充電が停止します。 また、バッテリー温度が90℃以上になると充電が切れる仕組みも搭載。 いくつかの 現代モデルバッテリーの設計には機械式スイッチがあります。 これは、バッテリーケース内の圧力の上昇によって引き起こされます。 電子ボードの電圧制御メカニズムは、ジャーを外界から最小および最大電圧で切断します。
保護されていないリチウムイオン電池があります。 マンガンを組成に含むモデルです。 この元素は、過充電されると、リチウム金属化の阻害と酸素の放出に寄与します。 したがって、そのようなバッテリーでは、保護が不要になります。
リチウムイオン電池の保存・放電特性
リチウムタイプのバッテリーは保管状態にもよりますが、保管状態にもよりますが、年間の自己放電はわずか 10 ~ 20% です。 しかし同時に、バッテリーセルの劣化は、使用しなくても進行します。 一般に、リチウムイオン電池のすべての電気パラメータは、特定のインスタンスごとに異なる場合があります。

例えば、放電時の電圧は、充電の度合い、電流、周囲温度などによって変化します。バッテリーの寿命は、電流と放電充電サイクルのモード、温度の影響を受けます。 リチウムイオン電池の主な欠点の 1 つは、充放電モードに対する感度です。 他の種類保護
下のグラフは、リチウムイオン電池の放電特性を示しています。 彼らは、放電電流と周囲温度に対する電圧の依存性を考慮しています。
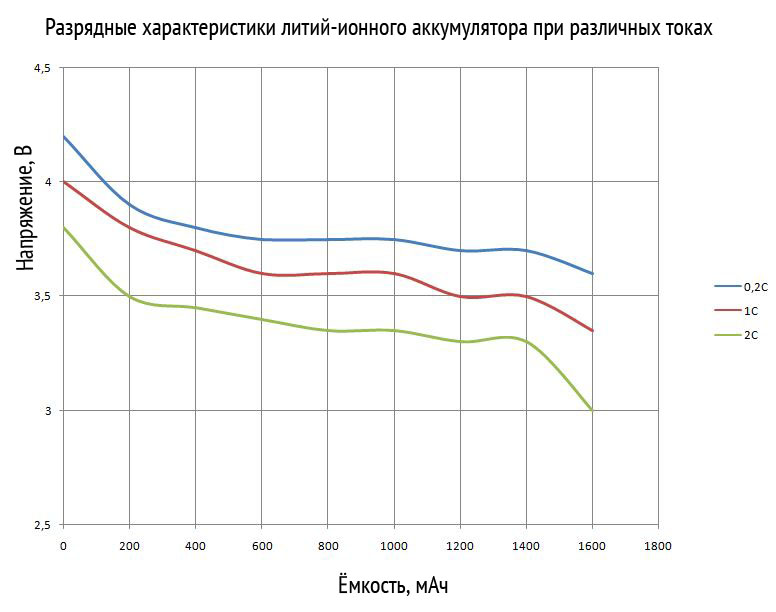
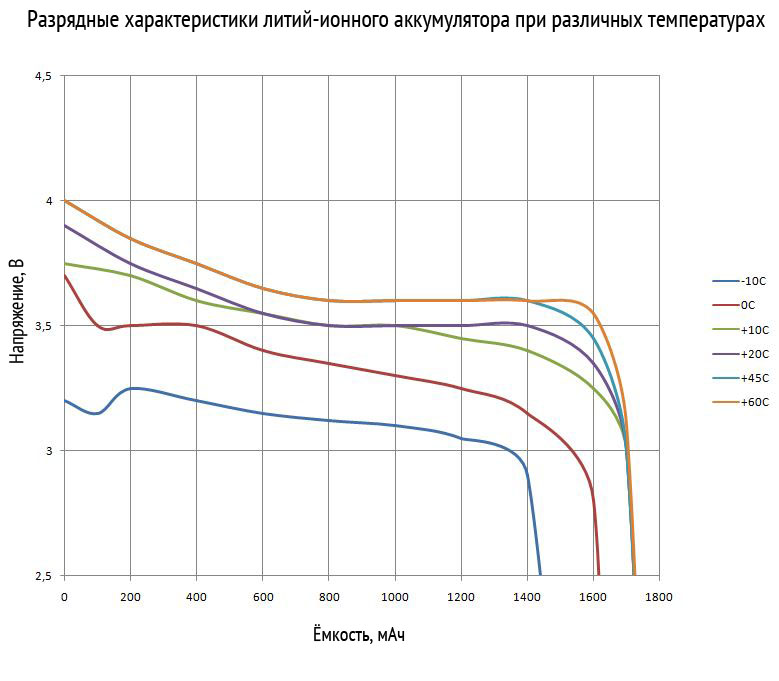
ご覧のとおり、放電電流が増加しても、静電容量の低下はわずかです。 しかし同時に、動作電圧は著しく低下します。 摂氏 10 度以下の気温でも同様の現象が見られます。 バッテリーの初期電圧降下にも注意が必要です。
アルカリ ニッケル技術は、Waldmar Jungner が最初のニッケル カドミウム電池 (NiCD) を発明した 1899 年に導入されました。 当時は使用材料が高価であり、その使用は特殊な機器に限られていました。 このタイプのバッテリーには、ニッケル陽極とカドミウム陰極があります。 1932年には多孔板ニッケル電極に活物質を導入し、1947年からは充電時に放出される内部ガスが内部で再結合し、従来のように外部に放出されない密閉型NiCD電池の研究が始まりました。 これらの改良により、現在使用されている最新の密閉型 NiCD バッテリーが生まれました。
現時点では、ポータブル ラジオ、医療機器、業務用ビデオ カメラ、録音機器、強力なツールの電源として、依然として NiCD バッテリが最も人気があります。 そのため、携帯機器用の全バッテリーの 50% 以上が NiCD です。 電気化学システムの面での新しいバッテリーの出現は、NiCD バッテリーの使用の減少につながりましたが、新しいタイプのバッテリーの欠点の特定は、NiCD バッテリーへの新たな関心につながりました。
ニッカド電池は、一生懸命働き、あまりトラブルを起こさない、強く静かな労働者のようなものです。 低速充電よりも高速充電を優先し、充電よりもパルス充電を優先します 直流. 効率の改善は、放電パルスを充電パルス間に分配することによって達成される。 一般に逆充電と呼ばれるこの充電方法は、電極の高い活性表面積を維持し、それによってバッテリーの効率と寿命を延ばします。 逆充電は急速充電も改善します。 充電中に放出されたガスの再結合を助けます。 その結果、バッテリーの発熱が少なくなり、標準の DC 充電方法よりも効率的に充電できます。
逆充電を使用する場合に解決されるもう 1 つの重要な問題は、バッテリー セル内の結晶形成の減少です。これにより、効率が向上し、寿命が延びます。 ドイツで実施された調査によると、逆充電により NiCD バッテリーの寿命が約 15% 延びることが示されています。
ニッカド電池が入っていると有害です 充電器数日以内に。 実際、ニッカド電池は、定期的に完全に放電したときに最高の性能を発揮する唯一のタイプの電池です。 電気化学システムによる他のすべてのタイプのバッテリーは、浅い放電を好みます。 そのため、ニッカド電池は定期的な完全放電が重要であり、これが行われないと、メモリ効果と呼ばれるセルプレート上に大きな結晶が形成されることにより、ニッカド電池は徐々に効率が低下します。
ニッカド電池の欠点として、定期的な充電の必要性があります。 完全放電動作特性を維持し (メモリー効果を排除)、高い自己放電 (最初の 24 時間で最大 10%)、および他のタイプのバッテリーと比較して大きな寸法を維持します。 また、バッテリーにはカドミウムが含まれており、特別な処分が必要です。 このため、スカンジナビアの多くの国では、すでに使用が禁止されています。 サイズが大きく、ニッカド電池の廃棄に問題があるため、携帯電話市場から徐々に離れつつあります。
NiMh - ニッケル水素電池
20 世紀の 60 年代後半にさかのぼると、科学者は原子状水素を 1000 倍の体積で結合できる多くの合金を発見しました。 それらは水素化物と呼ばれ、化学的には通常、亜鉛、リチウム、ニッケルなどの金属の化合物です。 賢く使えば、水素化物は電池内の可逆反応に使用するのに十分な量の水素を蓄えることができます。 水素化物カソードとニッケルアノードがあります。NiMH バッテリ技術の研究は 1970 年代に始まり、ニッケルカドミウムバッテリの欠点を克服する試みとして開始されました。 しかし、当時使用されていた水素化金属化合物は不安定で、求められる特性が得られませんでした。 その結果、ニッケル水素電池の開発は鈍化しました。 1980 年代に、バッテリー用途に十分安定した新しい金属水素化物化合物が開発されました.80 年代後半以降、NiMH バッテリーは、主にエネルギー貯蔵密度の点で絶えず改善されてきました. 彼らの開発者は、NiMH 技術がさらに高いエネルギー密度を達成する可能性を秘めていることに注目しました。
NiMH バッテリの充放電サイクル数は約 500 回です。深い放電よりも浅い放電が好まれます。 バッテリーの寿命は、放電深度に直接関係しています。
NiMH バッテリは、NiCd バッテリよりも充電中に大幅に多くの熱を発生するため、温度制御を使用しない場合、完全に充電されたことを検出するには、より洗練されたアルゴリズムが必要です。 ほとんどの NiMH バッテリには、フル充電を検出するための追加基準を提供する内部温度センサーが装備されています。 また、NiMH バッテリーはそれほど速く充電できません。通常、充電時間は NiCD の 2 倍です。 フローティング充電は、NiCd バッテリよりもさらに制御する必要があります。
NiMH バッテリの推奨放電電流は、NiCD の場合よりもはるかに小さくなります。 そのため、メーカーは 0.2C ~ 0.5C (定格容量の 1/5 ~ 1/2) の負荷電流を推奨しています。 必要な負荷電流が低い場合、この欠点は重要ではありません。 高負荷電流を必要とするアプリケーションや、 衝撃荷重携帯ラジオや強力な楽器など、ニッカド電池の使用をお勧めします。
NiMH および NiCD バッテリの自己放電は許容範囲内です。 NiCD バッテリは、最初の 24 時間で容量の約 10% を失い、その後の自己放電率は 1 か月あたり約 10% です。 NiMH バッテリーの自己放電は、NiCD の 1.5 ~ 2 倍です。 自己放電を減らすために水素結合を改善する水素化物材料を使用すると、通常、バッテリー容量が減少します。
ニッケル水素電池の容量は、同じサイズの標準的なニッカド電池よりも約 30% 大きくなっています。 非常に大容量の NiCD セルは、NiMH に近いレベルの容量を提供します。
NiMHバッテリーの価格は、NiCDよりも約30%高くなります。 ただし、ユーザーが必要とする場合、価格は主な問題ではありません 大容量そして小さな次元。 それに比べて、非常に大容量のNiCDセルは、標準のNiCDセルよりもわずかに高価です。 容量/コストの点では、非常に大容量の NiCD バッテリーは NiMH よりも経済的です。
Li-Ion - リチウムイオン電池
リチウムは最も反応性の高い金属です。 それに基づいて、ラップトップ用の最新の電源が機能します。 ほとんどすべての高密度電源はリチウムを使用しています。 化学的特性. 1 キログラムのリチウムは、3860 アンペアアワーを蓄えることができます。 ちなみに、亜鉛の指数は820、鉛の指数は260です。リチウム電池は、負極の種類によって1.5ボルトから3.6ボルトの電圧を発生させることができ、他のどの元素よりも高い電圧を発生させることができます。
問題は、リチウムが活性すぎることでした。 リチウムは最も軽い金属ですが、非常に負の電気化学ポテンシャルも持っています。 このため、リチウムは理論値が最も高いという特徴があります。 電気エネルギー. リチウムに基づく二次電流源は、放電電圧が高く、静電容量が大きい。
リチウム電池に関する最初の研究は、G.N. によって行われました。 1912年のルイス。 しかし、一次リチウム電流源の最初の商用コピーが登場したのは 1970 年のことでした。 再充電可能なリチウム電流源を開発する試みは 80 年代にさかのぼりますが、取り扱い時に許容レベルの安全性を確保することが不可能であったため、成功しませんでした。
80年代に行われた研究の結果、金属リチウム電極を備えた電流源のサイクル中に、リチウムの表面にデンドライトが形成されることがわかりました。 デンドライトが正極に成長し、リチウム電流源内部で短絡が発生すると、電池の故障の原因となります。 この場合、電池内部の温度がリチウムの融点(180℃)に達することがあります。 リチウムと電解質との激しい化学的相互作用の結果、爆発が発生します。 たとえば、1991 年に日本に出荷された大量のリチウム電池は、携帯電話の電池が爆発した結果、数人がやけどを負った後、メーカーに返送されました。
リチウムイオン電池の動作原理
電池メーカーは、リチウムをイオンの形で使用しようとしました。 安全なリチウムベースの電流源を作成する試みでは、研究により、バッテリー内のサイクル不安定なリチウム金属が、炭素および遷移金属酸化物のリチウム格子間化合物に置き換えられました。 したがって、気まぐれな金属の形をいじることなく、有用な電気化学的性質をすべて得ることができました。
リチウム イオン電池では、リチウム イオンは他の材料の分子によって結合されます.現在、リチウム イオン電池を作成するための最も一般的な材料は、グラファイトとリチウム コバルト酸化物 (LiCoO2) です。 このような電流源では、充放電の過程で、リチウムイオンが格子間電極から別の電極へ、またその逆に移動します。 これらの電極材料は、リチウムよりも数倍低い比電気エネルギーを持っていますが、それらに基づく電池は、充放電プロセス中に特定の予防措置が講じられていれば、非常に安全です。 1991 年、同社は ソニースタートリチウムイオン電池の商業生産であり、現在最大のサプライヤーです。
リチウム イオン電池の固有の特性は、ニッケルカドミウム電池の特性の少なくとも 2 倍であり、作業時によく特徴付けられます。 大電流これは、携帯電話やラップトップ コンピューターでこれらのバッテリーを使用する場合などに必要です。 リチウムイオン電池の自己放電はかなり少ないです (1 か月あたり 2 ~ 5%)。
安全性と耐久性を確保するために、各バッテリー パックには次のものが装備されている必要があります。 電気回路充電中に各セルのピーク電圧を制限し、放電時にセル電圧が許容レベルを下回らないように制御します。 さらに、最大充放電電流を制限し、セル温度を制御する必要があります。 これらの予防措置が守られていれば、動作中に電極の表面にリチウム金属が形成される可能性(ほとんどの場合、望ましくない結果につながる)は実質的に排除されます。
負極の材料によると、リチウムイオン電池は主に2つのタイプに分けることができます。
・コークス系負極(ソニー)
-グラファイトに基づいています(他のほとんどのメーカー)。
グラファイトベースの負極電流源は、コークス電極電池のより平坦な放電曲線と比較して、放電の終わりに急激な電圧降下を伴うより滑らかな放電曲線を持っています。 そのため、可能な限り高い容量を得るために、通常、コークス負極を使用した電池の放電終止電圧は、グラファイト電極を使用した電池 (最大 3 V) に比べて低く設定されます (最大 2.5 V)。 さらに、グラファイト負極を備えたバッテリーは、コークス負極を備えたバッテリーよりも高い負荷電流と充電および放電中の発熱を提供できます。
メーカーは、リチウムイオン電池の技術を絶えず改善しています。 電極材料と電解質組成の絶え間ない調査と改善があります。 並行して、個々の電源レベルと制御回路レベルの両方で、リチウムイオン電池の安全性を向上させる取り組みが行われています。
リチウムイオン電池は、現在市場で入手できる最も高価なものです。 生産技術を改善し、酸化コバルトを安価な材料に置き換えることで、今後数年間でコストを 50% 削減できる可能性があります。
発表された研究結果からも明らかなように、他のリチウムイオン技術は発展を続けています。 このように、富士フイルムによると、同社が開発した負極用スズ系非晶質複合酸化物材料は、1.5 倍の 電気容量標準的な炭素電極を備えたバッテリーと比較して。 この材料を使用したバッテリーの考えられる利点は、安全性の向上、充電の高速化、優れた放電特性、および 高効率低温で。 研究の初期段階における欠点は通常言及されていません。
リチウムイオン電池は非常に高いエネルギー密度を持っています。 取り扱いおよびテストの際には注意してください。 バッテリーをショートさせたり、過充電したり、つぶしたり、分解したり、金属物を突き刺したり、差し込んだりしないでください。 逆極性高温にさらさないでください。 身体的危害の原因となる場合があります。
Li-Pol - リチウムポリマー電池
これは、リチウム技術における最新のイノベーションです。 アノードは、リチウム塩を含むポリアクリロニトライトなどの複合材料であるポリマーバッフルによってカソードから分離されています。 その結果、ゲル状電解質の漏出が不可能であるため、セルの設計を単純化することが可能になる。 したがって、同じ比重で、最適な形状のリチウム ポリマー電池は、同様のリチウム イオン電池よりも 22% 多くのエネルギーを蓄えることができます。 これは、コンパートメントの隅にある「死んだ」ボリュームを埋めることによって達成されます。これは、円筒形バッテリーの場合は使用されないままです。
これらの明白な利点に加えて、リチウム ポリマー電池は、外部金属ケースがないため、環境にやさしく軽量です。
